Senin, 06 Februari 2017
Jumat, 03 Februari 2017
Kisi - kisi Ulangan Larutan Elektrolit kelas X Tahun 2017
1. Menjelaskan Pengertian dan memberikan contoh Larutan, Larutan Elektrolit Kuat, Lemah, Non Elektrolit
2. Menjelaskan dan memberikan contoh Senyawa Ion, Senyawa Kovalen
3. Menjelaskan Teori Arrhenius tentang Larutan Elektrolit
4. Menjelaskan cara larutan Menghantarkan arus listrik
2. Menjelaskan dan memberikan contoh Senyawa Ion, Senyawa Kovalen
3. Menjelaskan Teori Arrhenius tentang Larutan Elektrolit
4. Menjelaskan cara larutan Menghantarkan arus listrik
5. Menjelaskan Kekuatan Elektrolit
6. Menjelaskan cara membuat Alat Penguji Larutan
7. Menjelaskan Prosedur kerja Praktek Menguji Daya hantar listrik pada larutan
8. Menganalisa hasil percobaan tentang elektrolit
Senin, 16 Januari 2017
TATA NAMA SENYAWA KIMIA MENURUT IUPAC
TATA NAMA SENYAWA KIMIA MENURUT IUPAC
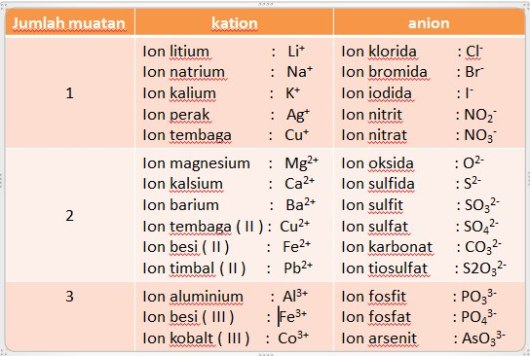
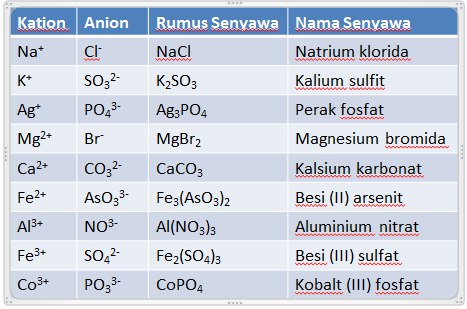
A. Tata Nama Senyawa Ion ( Terdiri dari atom logam dan nonlogam )
– Senyawa ion terdiri dari ion positif ( kation ) dan ion negatif ( anion ). Dalam
penamaan senyawa ion, kation disebut terlebih dahulu diikuti dengan nama
anionnya ditambah akhiran ida.
– Bila sebuah atom logam mempunyai lebih dari satu bilangan oksidasi, maka
untuk membedakannya biloks ini harus dituliskan dengan angka romawi
dalam tanda kurung
Beberapa nama kation dan anion
Contoh Penamaan Senyawa Ion
B. Tata Nama Senyawa Kovalen
untuk atom-atom non logam, pemberian nama dilakukan sesuai urutan berikut : B – Si – As – C – P – N – H – S – I – Br – Cl – O – F
kemudian ditambahkan akhiran ida
ex : HF diberi nama Hidrogen Fluorida
HI diberi nama Hidrogen Iodida
kemudian ditambahkan akhiran ida
ex : HF diberi nama Hidrogen Fluorida
HI diberi nama Hidrogen Iodida
Bila jumlah unsur dalam senyawa berbeda, maka untuk menyatakan jumlah masing-masing atom dalam rumus kimianya harus diawali dengan angka Yunani, yaitu :
1 = mono 6 = heksa
1 = mono 6 = heksa
2 = di 7 = penta
3 = tri 8 = okta
4 = tetra 9 = nona
5 = penta 10 = deka
Beberapa Nama Senyawa Kovalen
TATANAMA SENYAWA POLIATOM
Ion-ion poliatom adalah ion – ion yang tersusun oleh lebih dari satu jenis atom . Ion-ion ini dapat bersenyawa dengan ion-ion yang berasal dari atom logam. Senyawa yang terbentuk biasanya senyawa terner ( tersusun oleh tiga atom berbeda )
Aturan penamaan :
* untuk jumlah atom O = 1 , namanya : hipo…….it
* untuk jumlah atom O = 2 , namanya : ………….it
* untuk jumlah atom O = 3 , namanya : …………at
* untuk jumlah atom O = 4 , namanya : per ……at
* untuk jumlah atom O = 1 , namanya : hipo…….it
* untuk jumlah atom O = 2 , namanya : ………….it
* untuk jumlah atom O = 3 , namanya : …………at
* untuk jumlah atom O = 4 , namanya : per ……at
Contoh Senyawa Poliatom
Persamaan Reaksi Kimia
Persamaan reaksi merupakan suatu persamaan yang menggambarkan perubahan kimia dari pereaksi ( zat-zat yang bereaksi ) menjadi produk ( zat baru atau hasil reaksi ).
Pada penulisan persamaan reaksi, antara pereaksi dan produk dipisahkan oleh tanda panah. pereaksi ditulis sebelum tanda panah ( ruas kiri )sedangkan produk ditulis setelah tanda panah ( ruas kanan )
Dalam suatu persamaan reaksi, jumlah atom-atom dari zat yang bereaksi harus sama dengan jumlah atom-atom dari zat hasil reaksi
Aturan menyetarakan persamaan reaksi :
1. Jangan mengganti angka indeks, karena itu berarti mengganti rumus kimianya
2. Jangan menambahkan zat lain yang tidak ada dalam persamaan reaksi.
3. Setarakan jumlah atom dengan mengubah-ubah angka koefisiennya
4. Mulailah menyetarakan jumlah atom dari atom-atom yang memiliki indeks
paling besar dan atom-atom tersebut berada dalam satu zat, baik diruas kiri
maupun ruas kanan.
5. tetapkan koefisien reaksi dari zat dengan indeks terbesar tadi = 1 atau 2.
6. Setarakan jumlah atom yang terdapat lebih dari satu zat, baik diruas kiri maupun
ruas kanan.
Aturan menyetarakan persamaan reaksi :
1. Jangan mengganti angka indeks, karena itu berarti mengganti rumus kimianya
2. Jangan menambahkan zat lain yang tidak ada dalam persamaan reaksi.
3. Setarakan jumlah atom dengan mengubah-ubah angka koefisiennya
4. Mulailah menyetarakan jumlah atom dari atom-atom yang memiliki indeks
paling besar dan atom-atom tersebut berada dalam satu zat, baik diruas kiri
maupun ruas kanan.
5. tetapkan koefisien reaksi dari zat dengan indeks terbesar tadi = 1 atau 2.
6. Setarakan jumlah atom yang terdapat lebih dari satu zat, baik diruas kiri maupun
ruas kanan.
Contoh 1 :
Contoh 2 :
Kamis, 05 Januari 2017
Reaksi Redoks Berdasarkan Perubahan Bilangan Oksidasi
Reaksi Redoks
Berdasarkan Perubahan Bilangan Oksidasi
Tahukah Kamu?
Pada proses pembentukan senyawa kovalen, tidak terjadi
perpindahan elektron. Perhatikan contoh berikut ini.
N₂ (g) + 2O₂ (g) → 2 NO₂ (g) 2H₂ (g) + O₂ (g) → 2H₂O (g)
Menurut
konsep pengikatan dan pelepasan oksigen, kedua reaksi di atas termasuk reaksi
oksidasi karena keduanya melibatkan pengikatan oksigen. Akan tetapi, reaksi
tersebut tidak dapat dengan mudah dijelaskan menggunakan konsep serah terima
elektron karena keduanya merupakan senyawa kovalen dengan penggunaan bersama
pasangan elektron.
Dalam
berbagai reaksi redoks yang melibatkan spesi yang kompleks, kadang tidak mudah
untuk menentukan atom yang melepas elektron dan atom yang menangkap elektron.
Perhatikanlah reaksi redoks berikut.
2KMnO₄ + 3H₂SO₄ + H₂C₂O₄ → K₂SO₄ + 2MnSO₄ + 2CO₂ + 4H₂O
Pada
reaksi di atas, kita tidak bisa dengan mudah mengenali unsur yang melepas
elektron (mengalami oksidasi) dan unsur yang menangkap elektron (mengalami
reduksi).
Atas
dasar permasalahan tersebut, munculah konsep reaksi redoks berdasarkan
perubahan bilangan oksidasi. Reaksi redoks yang sukar dijelaskan dengan konsep
pengikatan dan pelepasan oksigen atau dengan konsep serah terima elektron, dapat
dengan mudah dijelaskan dengan menggunakan konsep perubahan bilangan oksidasi
yang akan kita pelajari pada topik ini.
◘◘◘◘ BILANGAN OKSIDASI ◘◘◘◘
Bilangan oksidasi (biloks) suatu unsur adalah bilangan
yang dimiliki suatu unsur dalam membentuk senyawa yang dapat bernilai positif,
negatif maupun nol. Bilangan oksidasi memiliki aturan tertentu seperti berikut.
Deret unsur berdasarkan keelektronegatifannya
Deret unsur berdasarkan keelektronegatifannya
Logam < H < P < C < S < I < Br < Cl < N < O < F
Unsur yang posisinya lebih kiri akan mempunyai biloks positif. Sementara itu, unsur yang posisinya lebih kanan akan mempunyai biloks negatif.
ATURAN BILANGAN OKSIDASI
1. Bilangan oksidasi unsur bebas (tidak bersenyawa) adalah nol.
Contoh:
Atom Na, Cu, Fe, O pada O2, N pada N2,
S pada S8, dan P pada P4 memiliki biloks nol (0) karena
merupakan unsur bebas.
2. Bilangan oksidasi ion tunggal adalah sama dengan muatan ion tersebut.
Contoh:
Pada ion Cu2+ , biloks atom Cu = +2.
Pada ion Fe3+ , biloks atom Fe = +3.
3. Jumlah bilangan oksidasi seluruh atom-atom dalam suatu senyawa netral
adalah nol.
Contoh:
Pada senyawa H2O, jumlah biloks dari 2 atom
H + 1 atom O = 0.
4. Jumlah bilangan oksidasi seluruh atom-atom dalam suatu senyawa ion
adalah sama dengan muatan ion tersebut.
Contoh:
Pada ion SO42- , jumlah biloks dari 1 atom S +
4 atom O = -2.
Pada ion NH4+ , jumlah biloks dari 1 atom N +
4 atom H = +1.
5. Unsur-unsur tertentu mempunyai bilangan oksidasi tertentu dalam
membentuk suatu senyawa.
Contoh:
Atom hidrogen (H) di dalam senyawa umumnya memiliki
biloks +1, kecuali dalam hidrida logam. Pada hidrida logam seperti NaH, LiH,
CaH2, MgH2, dan AlH3, atom hidrogen memiliki
biloks -1.
Atom oksigen (O) di dalam senyawa umumnya memiliki
biloks -2, kecuali dalam senyawa peroksida dan superoksida. Pada senyawa
peroksida seperti H2O2, Na2O2, dan
BaO2, atom oksigen memiliki biloks -1. Pada superoksida (OF2)
oksigen memiliki biloks +2.
Atom-atom golongan IA (Li, Na, K, Rb, Cs, dan Fr)
dalam senyawa selalu mempunyai bilangan oksidasi +1.
Atom-atom golongan IIA (Be, Mg, Ca, Sr, Ba) dalam
senyawa selalu mempunyai bilangan oksidasi +2.
Atom-atom golongan IIIA (B, Al, Ga) dalam senyawa
selalu mempunyai bilangan oksidasi +3.
◘◘◘◘ Reaksi Redoks Berdasarkan Perubahan Bilangan
Oksidasi ◘◘◘◘
Perubahan bilangan oksidasi menandakan adanya
perubahan jumlah elektron pada unsur, baik dalam senyawa ionik maupun senyawa
kovalen polar. Berikut ini contoh reaksi redoks berdasarkan perubahan biloks.
MnO₂ (s) + HCl (aq) → MnCl₂ (aq) + Cl₂ (g) + H₂O (l)
Untuk
menentukan unsur yang mengalami oksidasi dan unsur yang mengalami reduksi,
digunakan perhitungan bilangan oksidasi unsur seperti berikut ini.
Reaksi oksidasi : Cl– → Cl₂
-1 0
Biloks Cl bertambah
Reaksi oksidasi : MnO₂ → Mn2+
+4 +2
Biloks Mn berkurang
-1 0
Biloks Cl bertambah
Reaksi oksidasi : MnO₂ → Mn2+
+4 +2
Biloks Mn berkurang
Persamaan
reaksi readoksnya dapat ditulis secara lengkap sebagai berikut.
Pada contoh di atas, klor mengalami oksidasi (pertambahan bilangan oksidasi), sedangkan mangan mengalami reduksi (penurunan bilangan oksidasi). Penggunaan bilangan oksidasi pada reaksi redoks lainnya dapat dilihat pada contoh di bawah ini.
- Oksidator
= zat yang mengalami reduksi (mengalami penurunan bilangan oksidasi)
- Reduktor
= zat yang mengalami oksidasi (mengalami pertambahan bilangan oksidasi)
Lembar Kerja Siswa Larutan Elektrolit dan Non-elektrolit
LEMBAR KERJA SISWA
PRAKTEK LARUTAN ELEKTROLIT DAN NON ELEKTROLIT
MATA PELAJARAN :
KIMIA
MATERI PELAJARAN :
Larutan Elektrolit dan Non Elektrolit
NAMA :
1…………………………………………….. No Absen……………..
2…………………………………………….. No Absen……………..
3…………………………………………….. No Absen……………..
4…………………………………………….. No Absen……………..
KELAS :
X IPA …
Judul Praktikum
Tujuan Praktikum
Dasar Teori
a. Pengertian Larutan
b.
Pengertian
-
Larutan Elektrolit kuat
-
Larutan Elektrolit Lemah
-
Larutan Non-elektrolit
c.
Contoh
-
Larutan Elektrolit kuat
-
Larutan Elektrolit Lemah
-
Larutan Non-elektrolit
d.
Pengertian
-
Senyawa
Ion
-
Senyawa
Kovalen
e.
Contoh
-
Senyawa
Ion
-
Senyawa
Kovalen
f.
Teori Arrhenius tentang larutan elektrolit
g.
Cara Larutan Elektrolit Menghantarkan
Arus Listrik
h.
Kekuatan Elektrolit
Alat dan bahan
Cara kerja:
Gambar Rangkaian Alat Uji
Hasil Pengamatan
|
NO
|
Larutan
|
Hasil pengamatan
|
|||||
|
Nyala lampu
|
gelembung
|
||||||
|
terang
|
Redup
|
Tidak
|
Banyak
|
Sedikit
|
Tidak ada
|
||
|
1.
|
|||||||
|
2.
|
|||||||
|
3.
|
|||||||
|
4.
|
|||||||
|
5.
|
|||||||
|
6.
|
|||||||
|
7.
|
|||||||
|
8.
|
|||||||
|
9.
|
|||||||
Kesimpulan
Dari data percobaan tersebut di atas, maka
buatlah kesimpulan tentang :
1.
Dari hasil pengamatan diatas kemudian kelompokkan larutan
tersebut dibawah
ini kedalam larutan elektrolit dan non elektrolit
2.
Dengan cara yang sama pada point 1 diatas kemudian kelompokkan zat-zat elektrolit
tersebut kedalam elektrolit kuat dan elektrolit lemah
3.
Dengan cara yang sama pada point 1 diatas kemudian kelompokkan zat-zat elektrolit
tersebut kedalam senyawa ion dan senyawa kovalen
4.
Jelaskan Mengapa larutan elektrolit dapat menghantarkan listrik
dan larutan non-elektrolit tidak dapat menghantarkan arus listrik
Langganan:
Komentar (Atom)