TATA NAMA SENYAWA KIMIA MENURUT IUPAC
A. Tata Nama Senyawa Ion ( Terdiri dari atom logam dan nonlogam )
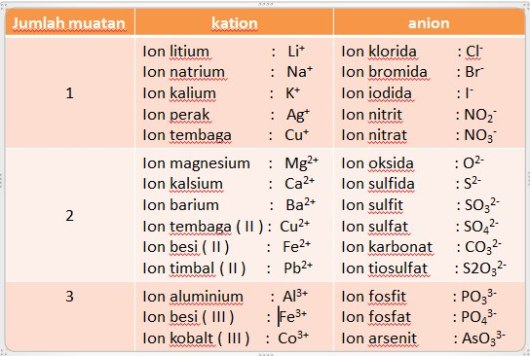
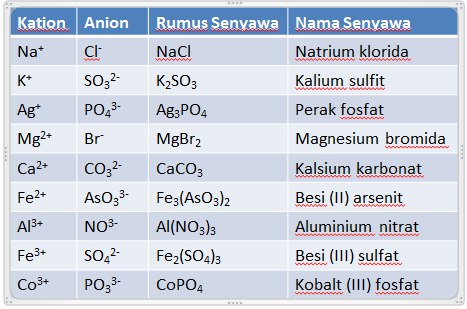
– Senyawa ion terdiri dari ion positif ( kation ) dan ion negatif ( anion ). Dalam
penamaan senyawa ion, kation disebut terlebih dahulu diikuti dengan nama
anionnya ditambah akhiran ida.
– Bila sebuah atom logam mempunyai lebih dari satu bilangan oksidasi, maka
untuk membedakannya biloks ini harus dituliskan dengan angka romawi
dalam tanda kurung
Beberapa nama kation dan anion
Contoh Penamaan Senyawa Ion
B. Tata Nama Senyawa Kovalen
untuk atom-atom non logam, pemberian nama dilakukan sesuai urutan berikut : B – Si – As – C – P – N – H – S – I – Br – Cl – O – F
kemudian ditambahkan akhiran ida
ex : HF diberi nama Hidrogen Fluorida
HI diberi nama Hidrogen Iodida
kemudian ditambahkan akhiran ida
ex : HF diberi nama Hidrogen Fluorida
HI diberi nama Hidrogen Iodida
Bila jumlah unsur dalam senyawa berbeda, maka untuk menyatakan jumlah masing-masing atom dalam rumus kimianya harus diawali dengan angka Yunani, yaitu :
1 = mono 6 = heksa
1 = mono 6 = heksa
2 = di 7 = penta
3 = tri 8 = okta
4 = tetra 9 = nona
5 = penta 10 = deka
Beberapa Nama Senyawa Kovalen
TATANAMA SENYAWA POLIATOM
Ion-ion poliatom adalah ion – ion yang tersusun oleh lebih dari satu jenis atom . Ion-ion ini dapat bersenyawa dengan ion-ion yang berasal dari atom logam. Senyawa yang terbentuk biasanya senyawa terner ( tersusun oleh tiga atom berbeda )
Aturan penamaan :
* untuk jumlah atom O = 1 , namanya : hipo…….it
* untuk jumlah atom O = 2 , namanya : ………….it
* untuk jumlah atom O = 3 , namanya : …………at
* untuk jumlah atom O = 4 , namanya : per ……at
* untuk jumlah atom O = 1 , namanya : hipo…….it
* untuk jumlah atom O = 2 , namanya : ………….it
* untuk jumlah atom O = 3 , namanya : …………at
* untuk jumlah atom O = 4 , namanya : per ……at
Contoh Senyawa Poliatom
Persamaan Reaksi Kimia
Persamaan reaksi merupakan suatu persamaan yang menggambarkan perubahan kimia dari pereaksi ( zat-zat yang bereaksi ) menjadi produk ( zat baru atau hasil reaksi ).
Pada penulisan persamaan reaksi, antara pereaksi dan produk dipisahkan oleh tanda panah. pereaksi ditulis sebelum tanda panah ( ruas kiri )sedangkan produk ditulis setelah tanda panah ( ruas kanan )
Dalam suatu persamaan reaksi, jumlah atom-atom dari zat yang bereaksi harus sama dengan jumlah atom-atom dari zat hasil reaksi
Aturan menyetarakan persamaan reaksi :
1. Jangan mengganti angka indeks, karena itu berarti mengganti rumus kimianya
2. Jangan menambahkan zat lain yang tidak ada dalam persamaan reaksi.
3. Setarakan jumlah atom dengan mengubah-ubah angka koefisiennya
4. Mulailah menyetarakan jumlah atom dari atom-atom yang memiliki indeks
paling besar dan atom-atom tersebut berada dalam satu zat, baik diruas kiri
maupun ruas kanan.
5. tetapkan koefisien reaksi dari zat dengan indeks terbesar tadi = 1 atau 2.
6. Setarakan jumlah atom yang terdapat lebih dari satu zat, baik diruas kiri maupun
ruas kanan.
Aturan menyetarakan persamaan reaksi :
1. Jangan mengganti angka indeks, karena itu berarti mengganti rumus kimianya
2. Jangan menambahkan zat lain yang tidak ada dalam persamaan reaksi.
3. Setarakan jumlah atom dengan mengubah-ubah angka koefisiennya
4. Mulailah menyetarakan jumlah atom dari atom-atom yang memiliki indeks
paling besar dan atom-atom tersebut berada dalam satu zat, baik diruas kiri
maupun ruas kanan.
5. tetapkan koefisien reaksi dari zat dengan indeks terbesar tadi = 1 atau 2.
6. Setarakan jumlah atom yang terdapat lebih dari satu zat, baik diruas kiri maupun
ruas kanan.
Contoh 1 :
Contoh 2 :